При делении клеток, две идентичные структуры, называемые центросомами, двигаются к противоположным полюсам клетки, чтобы помочь поделить ее хромосомы на две дочерние клетки. Ученые давно обнаружили, что аномальное увеличение числа центросом характерно для клеток злокачественных опухолей, но до сих пор было не понятно является ли наличие дополнительных центросом следствием или причиной развития рака. Биологи из университета Джона Хопкинса решили эту загадку, выяснив, что лишние центросомы могут сами способствовать образованию опухолей у мышей.
В ходе эксперимента ученые создали линию трансгенных мышей, представляющую собой модель для изучения рака наиболее адекватную из существующих на данный момент. Обычно мышиные модели опухолевого роста получают путем изменения одного гена или комбинации генов, которые запускают развитие определенного типа рака. Это часто приводит к возникновению опухоли, в которой клетки генетически схожи, тогда как в реальной ситуации злокачественная опухоль состоит из гетерогенных популяций опухолевых клеток, чем объясняется устойчивость опухоли к воздействию лекарственных средств. Увеличение числа центросом порождает генетическое разнообразие у мышей, что создает модели опухолей гораздо более схожих с человеческими.
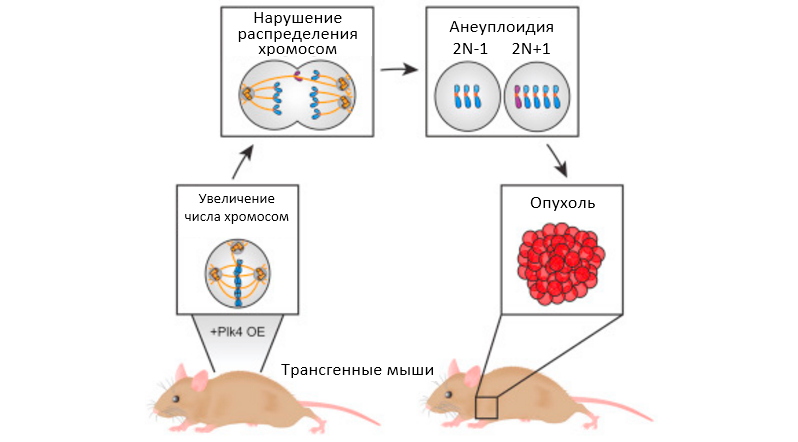
Во время клеточного деления центросомы помогают равномерно распределить хромосомы между дочерними клетками. Когда распределение хромосом идет не правильно, каждая новая клетка наследует либо слишком много или слишком мало хромосом. Это явление, известное как анеуплоидия, обнаруживается в 90% солидных опухолей человека.
В предыдущих исследованиях на клетках было показано, что избыточная продукция белка Plk4 (polo-like kinase 4) вызвала увеличение числа центросом. Чтобы узнать, каким образом белок Plk4 влияет на организм мышей, авторы исследования создали трансгенных мышей, ткани которых избыточно продуцируют белок Plk4. Во избежание летального исхода в результате анеуплоидии во время сложного процесса эмбрионального развития ученые создали мышей, которые станут продуцировать Plk4 только после приема антибиотика доксициклина. Прием антибиотика начинали, когда мыши достигали месячного возраста. Через месяц, после начала приема антибиотика, авторы посчитали количество центросом в тканях мышей и, как и предполагалось, нашли много случаев аномального увеличения числа центросом - в коже, селезенке, кишечнике, вилочковой железе, печени, поджелудочной железе и желудке.
Аномальное увеличение числа центросом в материнских клетках вызывало неправильное распределение хромосом в дочерних клетках, что, в свою очередь, приводило к неправильному распределению числа копий каждого гена, который наследует клетка. Каждое деление клеток с анеуплоидией увеличивает шанс появления мутаций, которых, в конце концов, накапливается достаточно, чтоб произошла злокачественная трансформация и образовалась опухоль.
У половины мышей с высокими уровнями Plk4 опухоли образовывались в течение 9-18 месяцев. Чаще всего опухоли возникали в тканях с повышенными числом центросом - в тимусе, селезенке и коже.
Авторы полагают, что это связано именно с увеличением числа центросом, а не с какой-либо другой ранее не известной функцией белка Plk4. Они объясняют это тем, что, во-первых, образование дополнительных центросом продолжалось даже после отмены месячного приёма антибиотика и последующего снижения уровня Plk4, а опухоли у мышей развивались спустя год и больше. Во-вторых, высокий уровень продукции белка Plk4 во время приема антибиотика наблюдался почти всех тканях мышей, однако опухоли формировались только в тех тканях, в которых увеличивалось количество центросом. Но при этом некоторые ткани, такие, как например, кишечник, хоть и имели лишние центросомы, однако опухоль на формировали. С чем это связано авторы планируют узнать в будущих исследованиях. Кроме того, в некоторых тканях, таких как легкие и почки, не происходило увеличение числа центросом, даже при высоких уровнях Plk4, и опухоль не образовывалась. Авторы объясняют это тем, что лишние центросомы формируются только в делящихся клетках. Легкие и почки относительно стабильны во взрослой мыши, и, несмотря на высокие уровни Plk4, клетки не делятся часто.
Белок Plk4 - это серин-треонин протеинкиназа -фермент, который кодируется геном PLK4 и локализуется в центриолях - сложных структурах образующих микротрубочки во время деления клеток. Высокая экспрессия приводит к увеличению числа центросом, а нокдаун гена PLK4, наоборот, приводит к утере центросом. Ингибиторы ферментативной активности белка Plk4 являются потенциальными противоопухолевыми агентами.