Т-лимфоциты часто перестают выявлять и уничтожать раковые клетки, так как они входят в дисфункциональное состояние, называемое «истощением» или «усталостью». В недавних исследованиях был проведён молекулярный анализ таких клеток, который позволил сделать определенные выводы полезные для клиники.
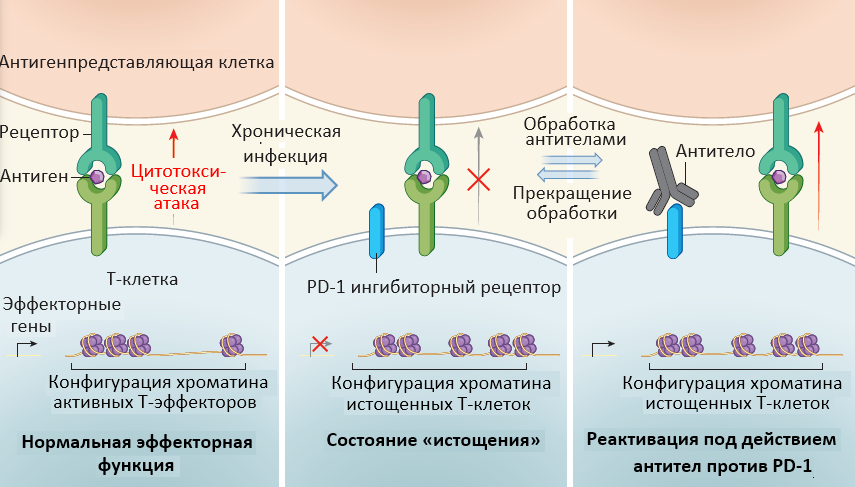
Цитотоксические Т-лимфоциты, которые экспрессируют на своей поверхности CD8 (CD8+ Т-клетки), атакуют вирусы и раковые клетки благодаря своей функции «найти и уничтожить» инфицированные или аномальные клетки. Однако, при некоторых хронических инфекциях или при попадании в микроокружение опухоли CD8+ Т-клетки часто теряют свою функциональную активность, входя в состояние «истощения». Несмотря на успехи в иммунотерапии, связанные с возможностью «приручить» иммунную систему и заставить ее бороться против раковых клеток, остается мало изученным то, как Т-клетки теряют свою работоспособность и как ее можно восстановить. Недавно было найдено, какие ключевые молекулярные изменения происходят в истощенных Т-клетках.
Когда CD8+ Т-клетки входят в состояние истощения, в них увеличивается экспрессия нескольких белков ингибиторных рецепторов, таких как PD-1, TIGIT, LAG3 и TIM3. Кроме того, у истощенных Т-клеток снижена способность продуцировать иммунные сигнальные молекулы – цитокины, такие как ИФН-γ и ФНО-α. Белки ингибиторных рецепторов снижают чувствительность клетки таким образом, что они перестают реагировать на наличие специфических антигенов, которые они в обычной ситуации легко распознают.
Блокировка ингибиторного рецептора (PD-1) и его лиганда (PD-L1) с помощью специфических антител - это революционный метод иммунотерапии рака последних лет, благодаря которому был разработан новый класс противоопухолевый препаратов - ингибиторов иммунных контрольных точек, способных усилить противоопухолевый иммунитет и обеспечить длительную опухолевую регрессию у людей, страдающих от рака. Однако остаются нерешенными вопросы: находятся ли истощенные Т-клетки в необратимом состоянии? Может ли блокада передачи сигналов через PD-1 и PD-L1 вызывать длительное перепрограммирование клеток в их прежнее функционально активное состояние, способное запускать продуктивный иммунный ответ?
Две группы учёных провели транскрипционный и эпигенетический анализ истощенных CD8+Т-лимфоцитов до и после обработки агентами против PD-1/PD-L1 и обнаружили, что, когда CD8+ Т-клетки входят в состояние «истощения», их транскрипционный профиль меняется, а со временем значительные изменения происходят и в хроматине. Оба коллектива наблюдали, что истощенные CD8+ Т-клетки приобретают эпигенетические модификации, которые отличаются от эффекторных Т-клеток. Pauken и соавторы показали, что на эпигенетическом уровне истощенные Т-клетки были поразительно не восприимчивы к воздействию антител против PD-L1. Таким образом, был сделан вывод, что, хотя антитела против PD-1 восстанавливают у «истощенных» Т-клеток их функциональную активность, их хроматин не приобретает прежних эпигенетических характеристик типичных для нормальных эффекторных Т-клеток.
Sen и соавторы обнаружили участок генома, в котором происходят изменения, при «истощённом» состоянии Т-клеток. Этот участок, локализован за 23,8 т.п.н. до участка гена PDCD1, кодирующего PD-1 рецептор, и может быть потенциальным сайтом связывания для транскрипционных факторов RAR, T-bet и Sox3, которые регулируют генную экспрессию. Когда ученые мутировали этот предполагаемый сайт связывания, экспрессия PD-1 в лимфоцитах снизилась. Эти результаты подтвердили, что этот участок генома может быть энхансером, т.е. сайтом, который регулирует экспрессию соседних генов. Однако, in vivo роль этого сайта в регуляции экспрессии PD-1 и функциональной активности Т-лимфоцитов пока не изучалась, а сама последовательность этого участка ДНК, по-видимому, не является эволюционно консервативной, что потенциально ограничивает прямое клиническое значение этих данных.
Учитывая, что удаление всего гена PDCD1 у мышей, вопреки очевидному, увеличивает «истощение» Т-клеток и их гибель с течением времени, такая «тонкая настройка» функционала Т-клеток путем делеции в участке энхансера PDCD1 гена может иметь значение для терапии рака в целом.
Pauken с коллегами изучили транскрипционные и эпигенетические изменения, которые происходят в CD8+ Т-лимфоцитах во время и после обработки анти-PD-1 препаратами. В течение всего периода обработки антителами профиль экспрессии генов у «истощенных» CD8+ Т-клеток был такой же, как у эффекторных Т-клеток. Однако, когда обработка антителами прекращалась, возвращался и характерный для истощенных CD8+ Т-клеток транскрипционный профиль, признаком чего была не способность этих клеток развиваться ни в эффекторные Т-клетки, ни в Т-клетки иммунологической памяти, необходимые для эффективного иммунного ответа при последующем контакте с антигеном. Эти результаты вместе с результатами другого исследования, в котором было показано, что в условиях аномально низких уровней лимфоцитов, бездействующие самореактивные Т-клетки могут войти на короткое время в эффекторное состояние, а затем снова вернуться в состояние покоя, наводят на мысль об эпигенетической роли в дисфункции Т-клеток. Если Т-лимфоциты человека ведут себя также как Т-лимфоциты мышей, которые были изучены группой Pauken, то клинические методы лечения с использованием антител, блокирующих PD-1, не приводят к выработке у больных Т-клеток, способных превращаться в эффекторные клетки и клетки памяти. Pauken с коллегами заметили, что хотя анти-PD-1 иммунотерапия не вызывала у мышей масштабного и длительного перепрограммирования истощенных CD8+ Т-клеток в функционально активные, однако способствовала восстановлению одного из важных свойств, характерных для Т-клеток памяти, – увеличение экспрессии рецептора ИЛ-7. Обнаружив это, авторы проверили сможет ли добавление ИЛ-7 в схему лечения улучшить терапевтический эффект анти-PD-1 и PD-L1 агентов, и выяснилось, что это действительно так. Этот результат подчеркивает важность изучения молекулярных механизмов для улучшения схем комбинированного лечения в клинике.
Еще одним важным результатом исследований обеих групп ученых является то, что они обнаружили потенциальные способы усиления эффекторной функции Т-клеток. Pauken и соавторы обнаружили, что эффекторные гены и в истощенных и в нормальных CD8+ Т-клетках имеют участки открытого хроматина, что может способствовать повторному сцеплению транскрипционных факторов, таких как NFAT, AP-1 or NF-κB, которые могут быть связаны с активированными CD8+ Т-клетками. Возможно, комбинированное лечение с применением антител против PD-1/PD-L1 и агентов, реактивирующих эти транскрипционные факторы, сможет посодействовать экспрессии эффекторных генов.
Несмотря на то, что обе группы исследователей показали, как происходит «истощение» Т-клеток на эпигенетическом уровне и как с этим можно бороться, неизменчивость эпигенетического состояния, характерного для истощения Т-клеток представляет собой серьёзную проблему. Многие перспективные низкомолекулярные ингибиторы, нацеленные на эпигенетические мишени, сейчас находятся на ранних стадиях клинических испытаний, и, действительно, могут в будущем сыграть определенную роль в терапии рака и других заболеваний. Однако, основные успехи будут достигнуты только при дальнейшем изучении молекулярных механизмов «истощения» Т-клеток.